耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus,MRSA)获得mecA,其编码细胞壁肽聚糖生物合成组分青霉素结合蛋白2a (penicillin-binding protein 2a,PBP2a),使其对β-内酰胺类抗生素产生耐药性,是临床关注的主要问题。这篇文章表明在抗生素的存在下,MRSA采用另一种细胞分裂模式,并在分裂隔膜(division septum)处显示出改变的肽聚糖结构。PBP2a可以取代内源性和必需的PBP2的转肽酶活性,但不能取代PBP1的转肽酶活性,PBP1负责独特的天然间隔肽聚糖结构(native septal peptidoglycan architecture)。没有PBP1活性的成功分裂需要不同的分裂模式,并由几种可能的染色体增强子(potentiator,pot)突变实现。MRSA增敏剂(resensitizing agent)对抗生素耐药性所需的两种相互依赖的干扰机制是不同的,这为新的干预措施提供了机会。
自最早的抗生素青霉菌进入临床起,伴随着抗生素的大量使用和细菌的快速进化,抗生素耐药性已经成为日益严峻的全球公共卫生威胁。
在青霉素用于治疗金黄色葡萄球菌后不久,对青霉素耐药的菌株就出现了;1959年,抗生素甲氧西林的诞生成功治疗了耐青霉素金黄色葡萄球菌菌株,但仅仅一年后,耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus, MRSA)感染的出现带来了新一轮的危机。如今,MRSA仍在严重威胁着人类健康,每年有超过12万人死于这种“超级细菌”。
MRSA的高度耐药性是如何形成的?本周,发表于《科学》杂志的最新研究告诉我们,原来我们一直小瞧了这些“超级细菌”的耐药本领。来自英国谢菲尔德大学的研究团队发现,除了已知的耐药机制,高度耐药性MRSA还可以通过一种前所未知的细胞分裂机制,在高浓度甲氧西林中生存、繁衍。这项发现为开发针对高度耐药菌的新型抗生素提供了新的机遇。

要理解MRSA的耐药机制,我们首先要知道,甲氧西林是如何杀死细菌的。甲氧西林属于β-内酰胺类抗生素,这也是如今最常见的抗生素类型。
细菌的生存离不开细胞壁的保护,而细胞壁的主要构造单元是由糖和氨基酸组成的肽聚糖。但只有肽聚糖还不够,要想将这些“砖块”砌成一堵“墙壁”,青霉素结合蛋白(penicillin-binding protein, PBP)扮演着 “水泥”的角色,这种酶可以将肽聚糖交联成完整的细胞壁,并且参与细胞壁的修复。
而β-内酰胺类抗生素的作用对象正是PBP。抗生素与PBP结合后,可以抑制后者的活性,阻止新细胞壁的形成与细胞壁修复,从而杀死失去了完整细胞壁保护的细菌。不过,MRSA的出现带来了新的变数。
MRSA在青霉素进入临床之前就已存在,而青霉素的使用作为一种选择压力,驱动了MRSA的传播。已有的研究认为,MRSA的耐药性是通过突变获得mecA基因而产生的。PBP包括了PBP1、PBP2等类型,而mecA基因可以编码一种独特的PBP酶——PBP2a。与天然PBP不同的是,PBP2a对β-内酰胺的亲和力很低,因此很难被β-内酰胺类抗生素结合。也就是说,这类抗生素无法抑制PBP2a的活性,这导致了MRSA可以在甲氧西林存在的情况下组装细胞壁、持续分裂。
不过需要指出的是,虽然是耐药菌,但绝大多数MRSA的耐药能力是有限的,只能在略高于最低抑菌浓度的甲氧西林中增殖。而造成更大健康威胁的,是MRSA中万里挑一的高度耐药性MRSA,这种现象称作异质性耐药性。
在高浓度抗生素环境中,只有这些极少数的高度耐药性MRSA可以延续细胞复制。这时,上面介绍的过程将不足以讲述这些MRSA耐药的完整故事。
为了找到高度耐药性MRSA可能的耐药新机制,研究团队首先使用能够展示细胞膜细节的原子力显微镜,对比观察了高度耐药性MRSA与甲氧西林敏感金黄色葡萄球菌(MSSA)的肽聚糖结构。
细菌分裂时,两个子代细胞中间部分的新细胞壁被称为隔膜(septa)。在没有抗生素的环境中,MSSA和MRSA的隔膜外表面展现出相同的特征——肽聚糖形成了如下图左所示的同心环状结构。
但在高浓度的甲氧西林环境中,不同细菌的隔膜外表面结构出现了分化。MSSA和普通MRSA的隔膜上出现了大的孔洞,遭到破坏的细胞壁也无法保护这些细菌;与此同时,高度耐药性MRSA的隔膜出现了令人意外的变化——同心环消失了,取而代之的是独特的小孔径致密网状肽聚糖结构(如下图右所示)。

▲不存在抗生素时,MRSA隔膜的肽聚糖形成同心环状结构(左);在高浓度抗生素存在时,高度耐药性MRSA的肽聚糖转变为小孔径致密网状(右)。(图片来源:参考资料[1])
接下来,研究团队解释了不同细菌中的肽聚糖结构变化。研究团队发现,让肽聚糖交联形成同心环状网络的,是PBP1蛋白。对于MRSA,mecA基因编码的PBP2a可以替代天然PBP2的活性,让细菌在低浓度甲氧西林中存活。然而,PBP2a无法替代PBP1的活性,因此在高浓度甲氧西林中,PBP2a无法修复出现大孔洞的细胞壁。因此,高度耐药性MRSA的存活以及全新的致密网状隔膜还需要其他的解释。
随后的分子分析找到了在高浓度抗生素环境中,高度耐药性MRSA可以切换的第二种分裂模式。rpoB基因编码RNA聚合酶基因的β亚基,研究发现第二种分裂模式正是由rpoB突变介导的。在PBP1活性缺失的情况下,rpoB突变以及其他几种pot突变使得隔膜形成独特的致密网状结构,维持了细胞壁的完整性。
由此,这项研究为我们描绘出了更加完整的MRSA耐药机制。首先,mecA突变让所有MRSA获得了抵御低浓度甲氧西林的能力;在此基础上,高度耐药性MRSA额外拥有的rpoB突变让它们在高浓度甲氧西林中也能延续细胞分裂。
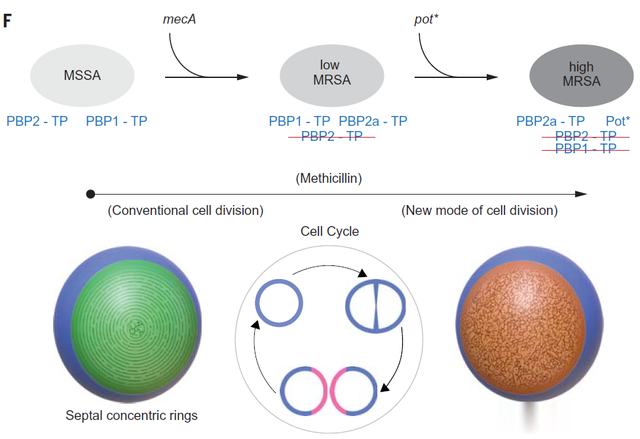
▲mecA突变和rpoB等pot突变共同构成了高度耐药性MRSA的耐药机制(图片来源:参考资料[1])
在揭示了高度耐药机制后,研究团队还进一步找到了几种化合物,用于抑制携带不同mecA、pbp2、pbp1和rpoB突变组合的金黄色葡萄球菌生长。同期的观点文章指出,这项新发现阐明了理解耐甲氧西林和更普遍耐药性的机制的重要性,并将促使人们找到克服对β-内酰胺类抗生素耐药的新疗法。
参考资料:
[1] Adedeji-Olulana et al., Two codependent routes lead to high-level MRSA. Science (2024). DOI: 10.1126/science.adn1369
[2] Ewan Harrison. Bacteria divide to conquer antibiotics. Science (2024). DOI: 10.1126/science.adt0042
